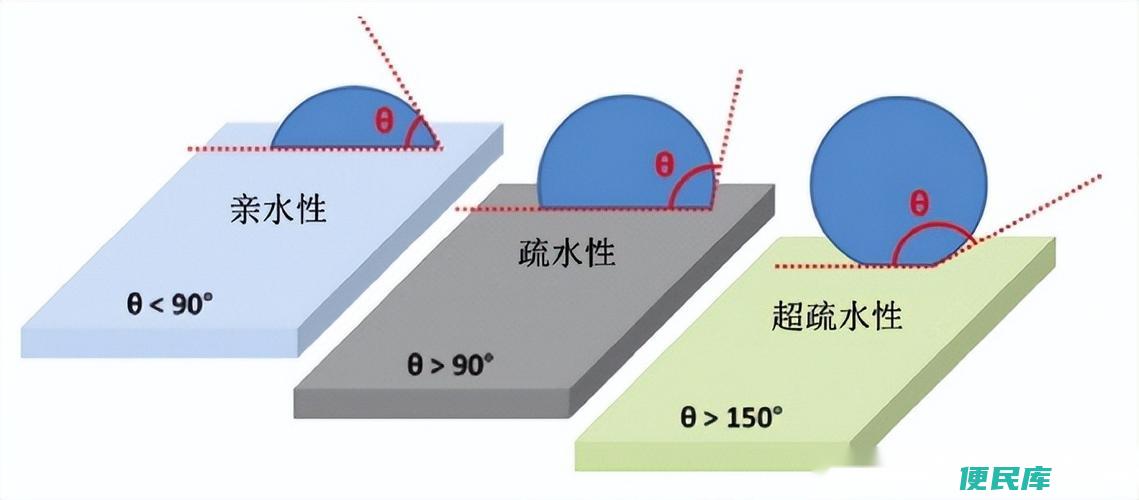
亲水性和疏水性是化学领域的两个重要概念,指物质与水接触时的喜好程度。
亲水性指物质喜欢与水接触,通常意味着水与物质之间有相互吸引力。
疏水性则相反,指物质不喜欢与水接触,通常意味着水与物质之间没有相互吸引力。
亲水性物质通常具有下列特征:
在水中能够溶解或分散,而不是在水表面形成团块
表面张力小,易于在水表面展开,形成“水母头”
水分子与物质分子之间可进行氢键作用或离子作用等相互作用
通常是极性分子,如各种醇、羧酸、醛、酮、胺等
疏水性物质通常具有下列特征:
不易在水中溶解或分散,而是在水表面形成团块或聚集在一起
表面张力大,不容易在水表面展开
通常是非极性分子,如各种烃类、脂肪类等
亲水性和疏水性都是描述物质与水接触时的性质,是相对的概念。一个物质可能同时具有亲水性和疏水性,只是程度不同。
亲水性和疏水性的不同点包括:
分子极性不同。 亲水性物质可能具有一定的分子极性,如醇、胺等含有小分子极性基团。疏水性物质通常是由非极性碳氢化合物构成。
氢键作用和范德华力作用不同。 亲水性物质与水之间主要是氢键力作用,这种作用比较强,能使物质充分分散在水中。
疏水性物质通常与水之间主要是范德华力作用,这种作用相对较弱,使得物质不能充分分散在水中,容易聚集成团。
表面张力不同。 通常亲水性物质的表面张力比较小,能够充分展开在水表面,疏水性物质的表面张力比较大,不容易展开在水表面。
分子间距离不同。 亲水性物质分子之间的距离通常比较短,这是因为分子之间能形成氢键和其他的相互作用力。疏水性物质分子之间的距离相对较远,这是因为范德华力作用力比较弱,不能有效吸引分子之间靠近。
亲水性和疏水性的概念在生物、自然、化学等领域都有广泛的应用。例如在药物研究中,亲水性和疏水性的概念可以用来描述分子间的相互作用、溶解度、生物利用度等。
在表面活性剂的制备中,也需要考虑分子的亲水性和疏水性,以达到良好的稳定性、分散性和乳化性。
亲水性和疏水性是描述物质与水接触时性质的两个重要概念。亲水性物质通常具有分子极性,容易在水中溶解和分散,与水之间主要是氢键作用;
疏水性物质通常由非极性分子构成,不容易在水中溶解和分散,与水之间主要是范德华力作用。亲水性和疏水性在药物研究、表面活性剂制备等领域都有广泛应用。
标签: 疏水性、 亲水性、 异同、 探讨、 区别、本文地址: https://www.bminku.com/bmxx/a3993114242699942777.html
上一篇:高血压注意事项高血压患者需注意什么...